分子栄養学的リーキーガット症候群予防対策①(プレバイオティクス・プロバイオティクス編)
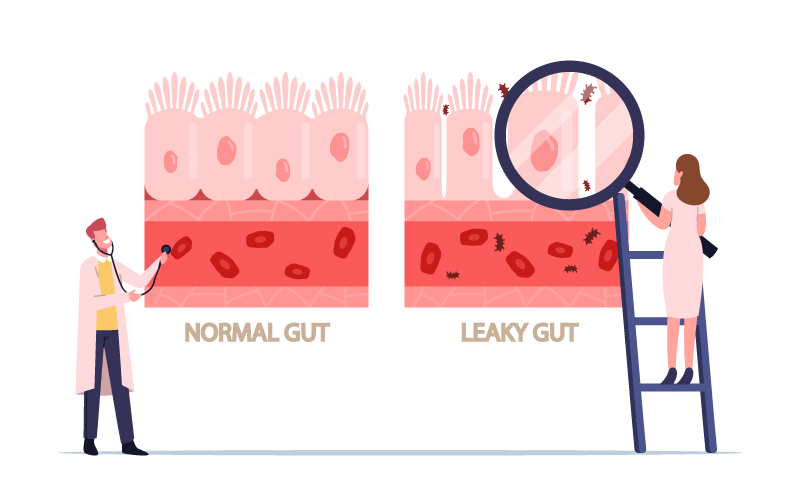
全身のさまざまな疾患の発症や悪化に関わるのではないかと考えられているリーキーガット症候群(以下、リーキーガットと略します)。今回は、最新の科学情報に則り、
・分子栄養学的なリーキーガット予防対策①(プレバイオティクス・プロバイオティクス編)
をお届けします。医師とともに腸の健康を維持するため、分子栄養学の得意分野における対策について最新の科学論文に沿って一緒に見ていきましょう。

正常な腸には栄養素などの必要なものを吸収しつつ、細菌やウイルスなどの不要なものを瞬時に判断して捨てる、という高度なシステムが整っています。これを可能にしていると考えられているのがタイトジャンクションです。
タイトジャンクションの破綻がリーキーガットの大きなひとつの原因と考えられています。(※あなたの腸は大丈夫? リーキーガット症候群理論編②))
腸や全身の余計な炎症を起こさないためにも、栄養素をしっかり消化・吸収していくためにも、常に正常なタイトジャンクションの調整が行われる健康で完全な腸粘膜バリアの状態を維持することが理想です※1。
腸粘膜の健康は、腸上皮細胞、免疫細胞、腸内細菌叢のバランスがいつも適切な状態で整い、お互いに繊細かつ複雑に作用し合うことによって維持されていると考えられています。
そしてその腸バリア機能の低下は、遺伝的な素因※2、腸の血液の流れなど(灌流)の低下、感染症※2、毒素、アルコール、薬物、ストレス※2、少ない食物繊維摂取量、ビタミンAやビタミンDなどの栄養素欠乏などが考えられています※3。しかし、その正確なメカニズムはまだまだ研究途中です※4。
腸内細菌叢を整える:十分な善玉菌のエサを定期的に。食物繊維を食べる
正確なメカニズムはまだ明らかになっていませんが、タイトジャンクション破綻の一説として、
・腸内細菌叢の乱れ
が挙げられています※5。
ヒトの腸には、1,000 種類、100兆個の細菌が棲んでいるといわれます※6。
適切な腸内細菌叢の種類・バランス・多様性は、腸管免疫の健やかな発育を促し、IgA抗体の産生量の維持などに関わることがわかっています。つまり、健康な腸にとって適切なバランスの腸内細菌叢は必要不可欠だということです。(※あなたの腸は大丈夫? リーキーガット症候群(理論編①))
人の腸内細菌叢は、遺伝よりも食事や薬物、肥満、血糖値などの環境因子の影響が大きいことが示されています※7。
自分の中にもともと棲んでいる共生細菌は、外から入ってくる病原体(外因性病原体)が定着しないように守ってくれています※8。
共生細菌は、
●善玉菌(有用菌):主に食物繊維など(プレバイオティクス)を分解する
●悪玉菌(有害菌):砂糖など(単糖類、二糖類)、動物性脂肪、タンパク質、アルコールなどを食べ、がんや動脈硬化などに関わる代謝物質をつくり出す
などに分けて考えられています※6。
善玉菌の代表は乳酸菌、ビフィズス菌など、悪玉菌の代表がウェルシュ菌などです。悪玉菌が多く善玉菌の少ない腸内細菌叢のバランスが崩れた状態をディスバイオーシスといい、さまざまな疾患に関わるのではないかと次々研究が報告されています。
善玉菌のつくり出す短鎖脂肪酸が腸を守る
善玉菌が食物繊維などを発酵してつくり出す短鎖脂肪酸(酪酸、酢酸、プロピオン酸)は、人体のエネルギー源となり、腸内を酸性に保ち、悪玉菌の繁殖を抑えます※9、※10。
酪酸は抗炎症作用も示され※11、大腸の主なエネルギー源となり、腸粘膜バリアを修復し※12、腸管に存在する制御性T細胞(Treg細胞)の誘導を促すことも示されています※13。
短鎖脂肪酸は、適切な腸管免疫を保つにも役立つということが示されています。
善玉菌はタイトジャンクションの強い味方?
一部のビフィズス菌などの善玉菌は、タイトジャンクションのタンパク質発現を刺激するなど、タイトジャンクション機能を強化するとの報告があります※14、※15、※16。
タイトジャンクションのバリア機能を向上させる手段などとして、
・プロバイオティクス
・プレバイオティクス
が有用ではないかと提案され、研究が進められています※17、※18。
粘液バリア(ムチン)と食物繊維
私たちの食習慣(高脂肪食、食物繊維の多い少ない、食品添加物、プロバイオティクス)は、粘液バリアに影響を与える大きな要因であることが示唆されています※19。
善玉菌の中には粘液バリアのムチンの厚さを正常にすると考えられている菌がいます。しかし腸内細菌のエサである食物繊維が少ないと、
・ムチン
を代わりに食べてしまう菌もいることも報告されています※5、※20、※21。ムチンが分解されてしまうことは、粘液バリアが薄くなってしまうことを意味します。(※あなたの腸は大丈夫? リーキーガット症候群(理論編①))
粘液バリアが薄くなると、
・腸上皮細胞に細菌が直接触れてしまう可能性
・理論的に通常は粘液層を通過できない菌が、感染する可能性
についての報告があります※19、※22。直接細菌が腸上皮細胞に触れてしまうことは、タイトジャンクションの破壊にダイレクトにつながるという報告があります※23。
・少ない食物繊維※21
・多い砂糖・ブドウ糖・果糖の摂取※24
によって、ムチンを分解する細菌が増えることが報告されています。

単純糖質(砂糖・単糖)と悪玉菌の関係
砂糖※18、アルコールなどは悪玉菌のエサとなり※6、腸内環境を悪化させると考えられています。
砂糖、果糖、ブドウ糖は腸内細菌叢のバランスを変化させ、大腸炎の発症に重要な役割をすることが報告されています※24。
たくさんの砂糖や果糖ブドウ糖液糖※25などの糖、アルコールをやめることは、根本となる問題を取り除くことにつながります。自分へのご褒美は、なるべくほかの食品やアクティビティで代替しましょう。
適切な衛生状態を保つ
タイトジャンクションの破綻は、病原体(細菌やウイルス)によってももたらされる可能性が報告されています※3。
例えばヒトの食中毒の原因菌のひとつ「ウェルシュ菌」は、タイトジャンクションのタンパク質(クローディン)に影響し、バリア機能を損ねるという報告があります※26。
また「大腸菌」などに感染すると、粘液の産生を阻害されたりすることが示されています※19、※27、※28。
外から入ってくる病原菌をはね返せるよう、普段から自分の腸管免疫システムを整え、適切な手洗いを習慣付けましょう。
海外旅行では特に水、氷、食品を含めた衛生状態にしっかり気をつけて楽しみましょう。
またしっかりよく噛むことは、唾液・胃酸でいくらか殺菌することにつながります。食事をよく噛んで食べることを普段から意識して実行しましょう。
6月に入り、高温多湿の食中毒の多い時季になりました。食材・食品の管理、調理の方法(生野菜は流水でしっかりと洗う、生肉・生野菜などを切る際の包丁やまな板の扱い方、魚肉類の加熱温度、調理後の保存方法など)にも気をつけましょう。
ウェルシュ菌は、カレーなどの煮込み料理を長時間放置することで増える食中毒菌です。

腸内細菌由来の内毒素(LPS)
私たちの身体の健康、恒常性や働きに害を及ぼす物質のことを毒素といいます※29。
腸内細菌のつくり出す毒素は、主に生きた細菌が外に分泌する外毒素と、内毒素(エンドトキシン、lipopolysaccharide:LPS)に分けて考えられています※29。
LPSは、タイトジャンクションを緩ませ、全身に炎症を起こす物質として注目されています。LPSはグラム陰性菌という細菌の細胞壁を構成する主な成分のことです※30。
LPSはタイトジャンクションの透過性増加に関わり、さらにLPSは腸内で、またリーキーガットによって全身に漏れ出して炎症を起こし、炎症性腸疾患、肥満や2型糖尿病などの代謝性疾患に関わることが報告されています※16、※30。
LPSをつくる細菌は、高脂肪食などで起こるディスバイオーシスで多く観察されるとの報告があります※14、※31、※32。
適切な食物繊維量の確保で毎日を快便に
分子栄養学では、適切な腸内細菌叢のバランスを保つため、
・適切な食事を大切に(※食事の基本)
・自分の腸に合ったプレバイオティクス(オリゴ糖、水溶性食物繊維など)
・プロバイオティクス(乳酸菌や酪酸菌など)
を一緒に摂ることをお勧めしています※33。
さまざまな食物繊維をたくさん含む食事をしっかりと、毎食よく噛んで食べることが大切です。その習慣で健全な粘液バリアを保ち、毎日1回定期的に “するっと出る” 切れの良いバナナ大のお通じで快便を目指しましょう。
便秘は、不要物や毒素を体内に溜め込んでいる状態です。毎日の便は腸の健康状態をお知らせしてくれる大切なお便りです。
分子栄養学的リーキーガット症候群予防対策②(生活習慣・栄養素対策編)では、健康な腸を保つための生活習慣や栄養素についてお届けします。
また※あなたの腸は大丈夫? リーキーガット症候群(理論編①)では、リーキーガット症候群とは何か、健康な腸とはどんな状態を指すかについてお届けしています。分子栄養学実践医師とともに身体の仕組みを勉強し、自分の腸の健康管理に役立てていきましょう。
※1 Luissint AC.,et al. Inflammation and the Intestinal Barrier: Leukocyte–Epithelial Cell Interactions, Cell Junction Remodeling, and Mucosal Repair. Gastroenterology,151(4): 616-632.(2016) ※2 Chelakkot C.,et al. Mechanisms regulating intestinal barrier integrity and its pathological implications. Experimental & Molecular Medicine,50:1-9.(2018) ※3 Bischoff C.S.et al. Intestinal permeability – a new target for disease prevention and therapy. BMC Gastroenterology, 14: 189. (2014) ※4 Horowitz A.,et al. Paracellular permeability and tight junction regulation in gut health and disease. Nature Reviews Gastroenterology & Hepatology. (2023) ※5 Twardowska A.,et al. Preventing Bacterial Translocation in Patients with Leaky Gut Syndrome: Nutrition and Pharmacological Treatment Options. International Journal of Molecular Sciences, 23(6): 3204. (2022) ※6 金井 隆典. 腸内細菌と消化器疾患. 日本内科学会雑誌, 108(9):1939-1945.(2019) ※7 Rothschild D.,et al. Environment dominates over host genetics in shaping human gut microbiota. Nature, 555:210-215.(2018) ※8 Buffie G.C.,et al. Microbiota-mediated colonization resistance against intestinal pathogens. Nature Reviews Immunology,13:790-801.(2013) ※9 Alakomi H.L.,et al. Lactic acid permeabilizes gram-negative bacteria by disrupting the outer membrane. Applied and Environmental Microbiology, 66(5):2001-2005.(2000) ※10 Malesza I.J.,et al. High-Fat, Western-Style Diet, Systemic Inflammation, and Gut Microbiota: A Narrative Review. Cells,10(11):3164.(2021) ※11 Bedford A.,et al. Implications of butyrate and its derivatives for gut health and animal production. Animal Nutrition, 4(2):151-159.(2018) ※12 Kelly C. J.,et al. Crosstalk between Microbiota-Derived Short-Chain Fatty Acids and Intestinal Epithelial HIF Augments Tissue Barrier Function. Cell Host Microbe, 17(5) :662-671.(2015) ※13 Furusawa Y.,et al. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells. Nature,504(7480):446-450.(2013) ※14 Malesza I.J.,et al. High-Fat, Western-Style Diet, Systemic Inflammation, and Gut Microbiota: A Narrative Review. Cells,10(11):3164.(2021) ※15 Anderson, R.C.,et al. Lactobacillus plantarum MB452 enhances the function of the intestinal barrier by increasing the expression levels of genes involved in tight junction formation.BMC Microbiology, 10:316.(2010) ※16 Chelakkot C.,et al. Akkermansia muciniphila-derived extracellular vesicles influence gut permeability through the regulation of tight junctions. Experimental & Molecular Medicine, 50:e450.(2018) ※17 Sanders E.M.,et al. Probiotics and prebiotics in intestinal health and disease: from biology to the clinic. Nature Reviews Gastroenterology & Hepatology, 16(10):605-616.(2019) ※18 Camilleri M.,et al. The Leaky Gut: Mechanisms, Measurement and Clinical Implications in Humans. Gut,68(8): 1516–1526.(2019) ※19 Paone P.,et al. Mucus barrier, mucins and gut microbiota: the expected slimy partners? Gut,69(12):2232-2243.(2020) ※20 Johansson MEV.,et al. Immunological aspects of intestinal mucus and mucins.Nature Reviews Immunology,16:639-649.(2016) ※21 Desai M.S.,et al. A dietary fiber-deprived gut microbiota degrades the colonic mucus barrier and enhances pathogen susceptibility. Cell,167(5): 1339–1353.e21.(2016) ※22 Li H.,et al. The outer mucus layer hosts a distinct intestinal microbial niche. Nature Communications,6:8292.(2015) ※23 Guttman JA.,et al. Evidence that tight junctions are disrupted due to intimate bacterial contact and not inflammation during attaching and effacing pathogen infection in vivo. Infection and Immunity,74(11):6075-6084.(2006) ※24 Khan S.,et al. Dietary simple sugars alter microbial ecology in the gut and promote colitis in mice. Science Translational Medicine,12(567):eaay6218.(2020) ※25 Jensen T.,et al. Fructose and sugar: A major mediator of non-alcoholic fatty liver disease. Journal of Hepatology,68(5):1063-1075.(2018) ※26 Luissint AC.,et al. Inflammation and the Intestinal Barrier: Leukocyte–Epithelial Cell Interactions, Cell Junction Remodeling, and Mucosal Repair. Gastroenterology,151(4): 616–632.(2016) ※27 Kim YS.,et al. Intestinal Goblet Cells and Mucins in Health and Disease: Recent Insights and Progress. Current Gastroenterology Reports,12:319–330.(2010) ※28 Cornick S.,et al. Roles and regulation of the mucus barrier in the gut. Tissue Barriers,3(1-2):e982426.(2015) ※29 西渕光昭. 毒素・薬毒物と中毒1 細菌毒素あれこれ. 化学と生物Vol. 39, No. 7, 20 (2001) ※30 Guo S.,et al. Lipopolysaccharide causes an increase in intestinal tight junction permeability in vitro and in vivo by inducing enterocyte membrane expression and localization of TLR-4 and CD14. The American Journal of Pathology, 182(2):375-387.(2013) ※31 Salguero M.V.,et al. Dysbiosis of Gram-negative gut microbiota and the associated serum lipopolysaccharide exacerbates inflammation in type 2 diabetic patients with chronic kidney disease. Experimental and Therapeutic Medicine, 18(5): 3461–3469.(2019) ※32 Cani P.D.,et al. Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes, 56(7):1761-1772.(2007) ※33 食物繊維、カリウムなどは、過敏性腸症候群、SIBO、腎臓病など病態によって摂り方が変わる場合があります。